成功的FDA 510(k)提交对您的市场成功至关重要。不完整或不准确的提交会导致失败,可能会推迟您的产品发布。
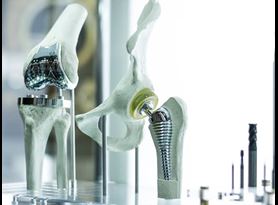
食物,药物和化妆品法案的510(k)或Premarket通知(PMN)部分要求制造商向FDA通知其在市场释放前90天推出新医疗设备的意图。具体而言,如果他们打算首次将设备引入商业分布或重新引入一个可能影响其安全性的重大变化的设备,则应提交510(k)或PMN。这种变化可以包括对设计,材料,化学成分,能源,制造过程或预期用途的修改。
我们通过文章中的最佳方法来介绍510(k)提交的最佳方法,5种方法,以确保您的510K提交测试在没有搭便车的情况下关闭。
我们的510(k)测试服务
Appropriately selected 510(k) testing of the predicate and submitted device must be designed and performed with the outcome documented and reported to demonstrate equivalence.
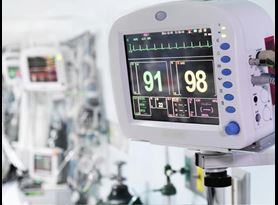
元素提供了广泛的测试服务,以帮助您从化学和机械测试到组合设备的药物测试中获得市场间隙。与您的监管团队密切合作,我们帮助您为510(k)提交选择适当的测试。除常用标准外,我们的订阅专家还可以制定用于评估没有标准化测试的设备的特定功能方面的非标准测试协议。
我们是FDA注册和ISO / IEC 17025认证,以确保我们执行的510(k)测试的技术完整性,确保您的设备被接受为提交的组成部分。
有关我们的医疗设备测试服务或要求引用的更多信息,联系我们今天。